腺苷
2020-05-29
#腺苷受体拮抗剂#和pd-L1抗体联合治疗可延长携带#肝癌#细胞小鼠的生存期。#腺苷#现在已是#肿瘤#的一个重要靶点。
腺苷受体在肿瘤中的作用已得到充分证实。尽管所有#腺苷受体#(A1、A2A、A2B和A3)都具有内在促癌和抑癌作用且彼此协同,但炎性或肿瘤组织中eADO的增加具有免疫抑制作用,与Gs蛋白偶联A2A受体(A2AR)过度刺激有关。Sitkovsky和他的团队的工作为肿瘤中A2A免疫调节提供了决定性的遗传证据,并为基于A2AR的抗#肿瘤免疫疗法#的发展奠定了基础。eADO触发的Gs信号传导活化腺苷酸环化酶,细胞内cAMP的持续积累作为“T细胞记忆”的分子基础,最终激活cAMP依赖性蛋白激酶A,负调节T细胞受体(TCR)依赖性跨膜信号的激活,为激活的免疫细胞提供“关闭”信号。
定向调控ATP-腺苷轴作为一种新型抗肿瘤免疫治疗策略提供了坚实基础。#CD39#与小分子抑制剂、#聚氧钨酸盐-1# (POM1)和ARL-67156或CD39阻断抗体OREG-103/BY40显著减轻了CD39+肿瘤细胞对CD4+和CD8+ T细胞反应的抑制,同时增加了细胞毒性CTL和NK细胞的活性,从而杀伤肿瘤细胞。CD39缺陷小鼠和野生型小鼠经POM-1处理后NK细胞也增加。
2023-05-11发表于上海
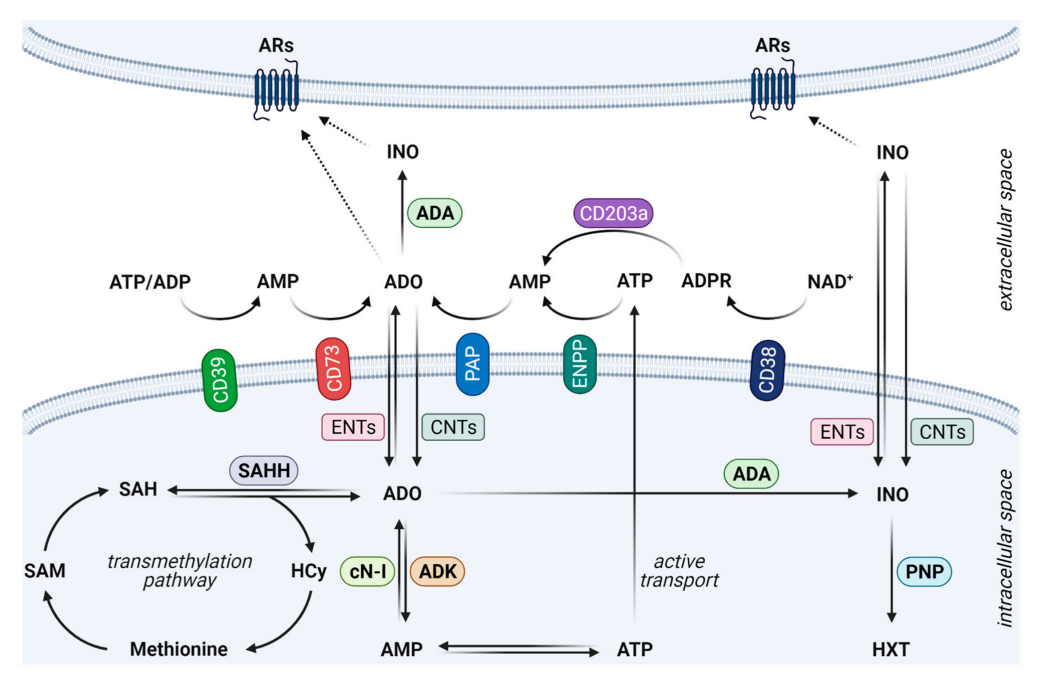
#腺苷# 腺苷(ADO)是一种无所不在、代谢迅速的嘌呤核苷,生理半衰期仅为几秒钟。因此,体内循环ADO的浓度很难测量。据报道,细胞外ADO(eADO)的生理浓度在纳摩尔水平,但在病理条件下,它们可能高达100mM。鉴于ADO的不稳定性,它主要通过自分泌和旁分泌信号发挥作用。它参与细胞能量转移,因为它是形成二磷酸腺苷(ADP)和三磷酸腺苷(ATP)的基础。此外,它在各种信号转导途径中发挥重要作用,是形成环磷酸腺苷(cAMP)等信号分子的一个组成部分。
eADO的主要来源是ATP分子,ATP被几种细胞类型的一系列膜定位酶水解为ADO,尤其是胞外核苷酸三磷酸二磷酸水解酶1(CD39)、胞外-5′-核苷酸酶(CD73)、外核焦磷酸酶/磷酸二酯酶(ENPP)和前列腺酸性磷酸酶(PAP)。eADO的产生也可能通过内在代谢途径进行,主要涉及腺苷激酶(ADK)、S-腺苷同型半胱氨酸水解酶(SAHH)、细胞质5′-核苷酸酶-I(cN-I)和细胞表面环ADP核糖水解酶(CD38)的NAD+补救途径。
近年来,针对腺苷途径成分的临床试验数量有所增加,但大多数试验仍处于开发的早期阶段。目前包括诺华、AZ、礼来、BMS、罗氏等在内的各大药企均积极布局着腺苷途径的药物研发,尚处于临床阶段,没有获批上市的药物,进展最快的药物研发为临床II期。
TTX-030是TizonaTherapeutics开发的靶向CD39的单克隆抗体。两项随机临床试验NCT03884556和NCT04306900分别发布于2019年3月和2020年3月,旨在研究其安全性和初步疗效,作为单一疗法和与经批准的抗PD-1免疫疗法(Pembrolizumab/Budigalimab)或标准化疗(多西紫杉醇、紫杉醇和吉西他滨)联合使用。同样,Innate公司最近开发了一种CD39阻断抗体(IPH520),并开始临床试验(NCT04261075),作为单一疗法和与抗PD-L1(Durvalumab)或抗CD73(Oleclumab)联合应用。
由于腺苷信号途径的复杂性,靶向腺苷疗法存在一些潜在的局限性和挑战。
受体相关限制
AR属于A类GPCR,主要由与细胞外结合位点结合的配体调节。AR信号的复杂性带来了一些限制,必须克服这些限制才能开发出有效的治疗方法。此外,AR认知的一个基本障碍是缺乏A2BR和A3R晶体结构,无法加深我们对A2BR和A3R构象动力学的理解。
ARs通常由小分子进行药理学调节,多靶点的参与是小分子存在的一个缺点。例如,选择性A2BR激动剂BAY 60-6583最近被证明与另一个靶分子结合,独立于A2BR上调CAR-T细胞活性。因此,如果不仔细评估,就不能排除ADO类似物可能具有多个目标的可能性。
实际环境的限制
在癌症中靶向腺苷途径可能是双向的。目前流行的观点认为CD73表达增加与不良临床结果有关;因此,一些针对CD73的抗癌治疗正在进行。然而,有报道发现CD73的缺失对子宫内膜肿瘤的进展至关重要,CD73在子宫内膜癌中TGF-β1的肿瘤抑制活性中起着关键作用。必须注意的是,尽管阻断CD73可能对某些肿瘤有益,但它可能有助于加速其他肿瘤的进展。
ADO降解酶ADA和PNP可能会改变ADO消耗和利用的平衡,可能是未来抗癌治疗的目标。然而,ADO脱氨基产物肌苷是一种AR激动剂,其半衰期比ADO长,并通过激活A3R和A2AR在小鼠体内发挥抗炎作用。因此,虽然通过代谢消除eADO可能导致癌细胞死亡,但其后果仍可能损害TME中的免疫细胞反应。
2023-05-11发表于上海






