2022 JAMA 试验方案中报告结果指南
试验方案中有关研究结果的完整信息对于获得监管批准、确保标准化试验进行、减少研究浪费、提供方法透明度以促进试验复制、批判性评估、对试验结果的准确报告和解释以及知识合成至关重要。
JAMA - 试验结果 - 2023-04-23
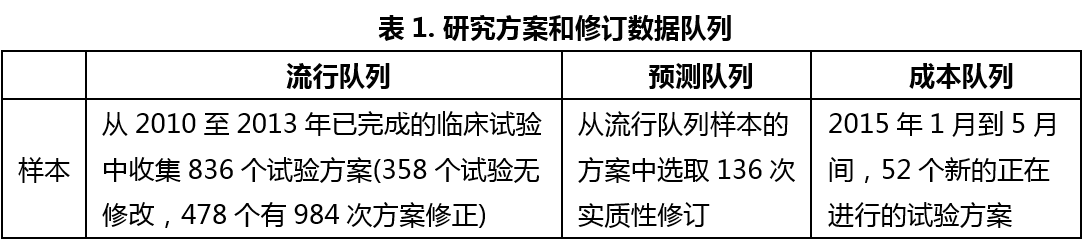
临床试验方案修订对临床试验结果和费用的影响
临床试验方案是保证临床试验顺利有序开展的前提,其一经制订并批准就应严格执行。在实际的临床试验开展过程中,有时对临床试验方案确有必要进行修订。但是,如果修订不够谨慎的话,就可能影响到试验结果、试验周期和试验经费。长期以来,对于制药公司和CRO公司而言,因临床试验方案的修订而导致的计划外的推迟、中断和花费都是很大的挑战。尽管拥有严格和深入的内部审查和批准流程,大多数定稿的方案还是会修订多次,特别是II
国际药品检查动态研究 - 试验方案,修订 - 2019-12-26
单病例随机对照试验方案清单(SPENT 2019)解读
单病例随机对照试验(N-of-1 trials)是一种基于单个患者所设计的多轮试验期交替的前瞻性临床随机交叉对照试验,可为临床决策者提供干预措施效果比较的高级别证据。近期,由多位学者组成的国际团队在B
中国循证医学杂志 - 单病例随机对照试验 - 2022-07-26
在试验方案中结果报告的指南:SPIRIT-Outcomes 2022 扩展
在试验方案中报告结果的指南:SPIRIT-Outcomes 2022 扩展
equator - 研究方案,临床研究方案 - 2023-01-04
急性吸入毒性试验方法
国家药品监督管理局组织起草了《化妆品毒理学试验方法样品前处理通则》等19项制修订项目并形成相应检验方法,经化妆品标准专家委员会全体会议审议通过,现予以发布。本文为《急性吸入毒性试验方法》。
国家药品监督管理局官网 - 毒性试验 - 2024-03-25
两项瑞德西韦治疗新冠肺炎的临床试验启动,来看试验方案!
医生在对该病人进行治疗的过程中,给予了尚未获批的药物Remdesivir(瑞德西韦,吉利德在研药物)进行试验性治疗,发现患者的病情迅速得到了控
医咖会 - 瑞德西韦,新冠肺炎 - 2020-02-11
leronlimab(PRO 140)治疗新冠肺炎的II期临床试验方案获得IND
CytoDyn是开发leronlimab(PRO 140)(具有多种适应症治疗潜力的CCR5拮抗剂)的生物技术公司,今日宣布,已向美国FDA提交了研究性新药申请(IND)。
MedSci原创 - 新冠肺炎,leronlimab(PRO 140),CCR5拮抗剂 - 2020-03-09
皮肤吸收体内试验方法
国家药品监督管理局组织起草了《化妆品毒理学试验方法样品前处理通则》等19项制修订项目并形成相应检验方法,经化妆品标准专家委员会全体会议审议通过,现予以发布。本文为《皮肤吸收体内试验方法》。
国家药品监督管理局官网 - 体内试验 - 2024-04-02
临床试验方案设计声明:SPIRIT 2013
临床试验的方案是研究计划、实施、报告和评估的基础。然而,试验方案和现有方案指南在内容和质量上差异很大。这篇文章描述了SPIRIT(Standard Protocol Items: Recommenda
Ann Intern Med . 2013 Feb 5;158(3):200-7 - 临床试验 - 2021-09-01
新药临床试验方案设计的研究
新 药临床试验是药品上市前最重要的研究环节之一。新药在上市之前,需要进行I-Ⅲ期的临床试验;上市后,需进行Ⅳ期临床试验,I-Ⅳ期的临床试验是对药物的 疗效、安全性及风险效益进行科学性、真实性及可靠性的临床疗效与安全性的评价研究。I-Ⅲ期的新药临床试验的数据,需提供给国家食品药品监督管理局 (SFDA)审查,以此作为重要的依据,来决定该药上市与否。全面的、结构清晰的临床研究方案,应该包括研
中国临床药理学杂志 - 临床试验,方案 - 2014-08-09
临床试验方案中患者报告结局(PRO)指南:SPIRIT-PRO扩展
患者报告结果 (PRO) 用于临床试验,以提供有关疾病和治疗对患者症状、功能和生活质量的影响的宝贵证据。来自试验的高质量 PRO 数据可以为共享决策、监管和经济分析以及卫生政策提供信息。最近的证据表明
BMJ Open. 2021; 11(6): e045105 - 患者报告结局 - 2021-09-01
为您找到相关结果约500个