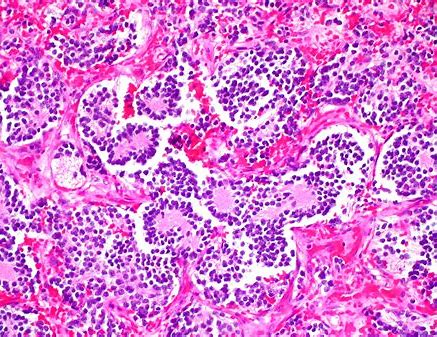
FDA批准DANYELZA(naxitamab-gqgk)治疗神经母细胞瘤
DANYELZA(naxitamab-gqgk)与粒细胞巨噬细胞集落刺激因子(GM-CSF)联用用于治疗1岁及以上的骨复发或难治性高危神经母细胞瘤患者。
MedSci原创 - FDA,神经母细胞瘤,DANYELZA(naxitamab-gqgk) - 2020-11-26
FDA批准PaxVax公司口服单剂量霍乱疫苗研发申请
近日,PaxVax公司口服单剂量霍乱疫苗研发新药申请(IND)获得美国食品药监局(FDA)批准。PXVX-0200是一种对抗霍乱的活性疫苗,先前曾以商品名为Orochol在其他六个国家获得批准。
cyy123 - 新药,FDA - 2012-04-25
EpiCept神经痛药物AmiKet获FDA快速审定资格
近日,EpiCept公司的AmiKet获得美国食品药监局(FDA)授予的快速审定资格,这是一种含有4%的阿米替林和2%的氯胺酮的药物。根据FDA的规定,获得快速审定资格的药物会获得有限审定权,比标准的审定时间要缩短大概一半。 EpiCept公司总裁兼首席执行官Jack Talley说:“我们希望通过这次
cyy123 - 新药,FDA - 2012-04-25
美国FDA新药审评时间决定性因素大揭秘
2014年4月美国The Manhattan Institute 发布了一项对美国FDA新药审批效率评价的研究报告,研究报告称美国FDA药物评价与研究中心(Center for Drug Evaluation
新康界 - FDA,美国,药物审批,时间 - 2015-10-29
响应“精准医疗” FDA要建立基因大数据共享平台!
然而,随着技术的日趋成熟,众多检测方法对FDA提出了尽快适应形势的要求。为了与精准医学计划相呼应,FDA计划建立一个名为“精准FDA”(precisionFDA)平台。最近,著名的生物信息学公司DNAnexus公司与FDA签订了第一份合作协议,可被看做是向前迈出了重要一步。尽管这次协议涉及的金额可以说是少的可怜,仅为
生物谷 - 精准医疗,FDA,大数据 - 2015-08-10
罕见病日 | FDA:用新举措迎接罕见病挑战
2月的最后一天是国际罕见病日。虽说是罕见病,但这些患者加起来的数量并不少。仅在美国,就有多达3000万人受罕见病影响——相当于每10个美国人中就有一名罕见病患者。从罕见癌症到遗传代谢疾病,现在已知的罕见病超过7000种。而可悲的是,有一半受罕见病影响的是儿童。
药明康德 - 罕见病,FDA,挑战 - 2018-02-28
FDA要求限制婴儿米糊中无机砷的含量
美国食品药品监督管理局(FDA)今天宣布希望减少婴儿米糊中无机砷的含量,以避免儿童出现可能的发育问题。
MedSci原创 - FDA,婴儿米糊,无机砷 - 2016-04-02
FDA授予Exelixis公司抗癌药cabozantinib优先审查资格
Exelixis公司今天宣布,FDA已接受审查该公司抗癌药cabozantinib的新药申请(NDA),该药用于不能手术切除的恶性局部晚期或转移性髓样甲状腺癌(medullary thyroid cancer同时,FDA已授予该药优先审查资格(priority review designation),这意味着FDA将在6个月内完成cabozantinib NDA的审查。 在今年
生物谷 - FDA,Exelixis公司,cabozantinib,优先审查 - 2012-08-01
FDA警告后微创子宫切除术数量减少
Am J Obstet Gynecol:自FDA指南发布以来越来越少的女性接受微创子宫切除术自从美国食品与药物管理局(FDA)警告反对使用称为子宫肌瘤分碎术的微创治疗子宫肌瘤的方法。2014年4月FDA首次发布安全通告后,密歇根地区接受子宫肌瘤分碎术的人数下降了1.7%。该研究结果现
MedSci原创 - FDA,子宫肌瘤切除术,微创 - 2015-09-15
Celgene向FDA提交红细胞成熟剂luspatercept的申请
Celgene公司已经向FDA提交了luspatercept药物相关申请,用于治疗依赖于红细胞(RBC)输血的骨髓增生异常综合症(MDS)和β地中海贫血。
MedSci原创 - 骨髓增生异常综合症,β地中海贫血,红细胞成熟剂,luspatercept - 2019-04-08
FDA仿制药一致性评价指导原则
有关FDA仍在考虑中的问题3. 更适合通过其他机制回复的问题 C. 一致性范围外的指南1. 一致性定义中的特殊情况2. 一致性范围外的主题3. 一致性范围外的实体IV.
MedSci原创 - FDA,仿制药,一致性评价 - 2018-11-01
InterMune治疗IPF药物获得FDA突破性药物认证
InterMune公司最近透露FDA已经确认授予其开发的治疗原发性肺纤维化(IPF)药物prifenidone突破性药物疗法,但并不会加快FDA对该药物的上市审核进程。在FDA的先期审查中,pirfenidone已经获得了相关专家的高度认可,因而此次获得突破性药物认证可能并不会加速这一药物的审核。按照原计
生物谷 - FDA,原发性肺纤维化 - 2014-07-23
FDA批准Imbruvica(Ibrutinib)用于治疗套细胞淋巴瘤
11月13日,美国食品药品管理局(FDA)批准了Imbruvica (Ibrutinib)可用于套细胞淋巴瘤(MCL)的治疗。
dxy - Imbruvica,细胞淋巴瘤 - 2013-12-13
FDA批准吡格列酮的首个仿制药上市
美国食品药品管理局(FDA)8月17日宣布,已批准2型糖尿病口服治疗药物吡格列酮的首个仿制药上市。
网络 - FDA,吡格列酮,仿制药,2型糖尿病 - 2012-08-21
为您找到相关结果约500个