Alzheimer's & Dementia:阿尔茨海默病大脑的糖基化成像图谱
2022-12-17 brainnew神内神外 brainnew神内神外 发表于安徽省
脑内葡萄糖的N-连接蛋白糖基化影响多种细胞过程,包括静息膜电位、轴突放电和突触囊泡运输。
导 读:
脑内葡萄糖的N-连接蛋白糖基化影响多种细胞过程,包括静息膜电位、轴突放电和突触囊泡运输。目前,正常人和阿尔茨海默病(AD)人脑内N-连接聚糖的空间图谱尚待明确。对空间N-连接聚糖的综合分析将提高我们对脑能量代谢的理解,将代谢与AD进展过程中受到干扰的信号事件联系起来可提示新的机制和治疗策略。近期《Alzheimer's & Dementia》期刊发表了题为"In situ spatial glycomic imaging of mouse and human Alzheimer's disease brains"的研究论文,作者团队报告了脑N-连接聚糖的酶辅助、基质辅助激光解吸和电离(MALDI)质谱成像(MSI)的优化原位工作流程。使用这一工作流程,他们在空间上研究了小鼠和人类AD大脑及其各自年龄匹配的对照组中N-连接聚糖异质性。作者在小鼠和人类中发现了与阿尔茨海默病相关的稳健的区域特异性N-连接聚糖变化。这些数据表明N-连接聚糖失调可能是AD病理的基础。
 01通过降低缓冲盐浓度提高空间分辨率
01通过降低缓冲盐浓度提高空间分辨率
原位N-连接聚糖的酶辅助 MALDI-MSI 已被用于多种不同癌症类型的空间分析,揭示了独特的肿瘤和基质空间差异。由于大脑中存在高水平的带岩藻糖和/或唾液酸修饰的带电N-连接聚糖,作者团队假设酶储存缓冲液中的盐晶体将与PNGase F裂解的N-连接聚糖相互作用并降低信号和空间定义。为了测试降低盐浓度是否改善MALDI-MSI 对脑糖基分析的信号和空间定义,该团队用PNGase F Prime在0.1X PBS中储存到0.01X PBS中进行过夜透析。透析后,将酶在0.01X、0.1X或0.2X PBS溶液中平衡,并使用WT小鼠大脑对N-连接聚糖进行MALDI-MSI工作流程(图1A)。在0.2X磷酸盐缓冲盐水(PBS)中使用PNGase F进行的MALDI-MSI分析显著降低了质谱检测到的N-连接聚糖的总丰度(图1B)。相反,在 0.01X PBS中使用PNGase F进行的MALDI-MSI分析显著改善了WT鼠脑中N-连接聚糖的总丰度和空间分布。例如,复合聚糖Hex3dHex1HexNAc4(m/z 1485约至最接近的1)在0.2x和0.1x PBS中用PNGase F制备的小鼠脑中普遍表达。然而,在0.01 X PBS中,用PNGase F处理的大脑有更高的强度和明显的定位(图1C)。类似地,当在0.01X PBS中用PNGase F处理时,高甘露聚糖Hex5HexNAc2(m/z 1257约至最接近的1)在腹侧纹状体及其周围区域显示出独特的定位(图1D),而在0.1x和0.2x PBS悬浮液中喷洒PNGase F的脑组织没有获得明显的空间信息。总的来说,他们的结果表明,降低盐浓度对于小鼠大脑样本中N-连接聚糖的空间分析是最佳的。
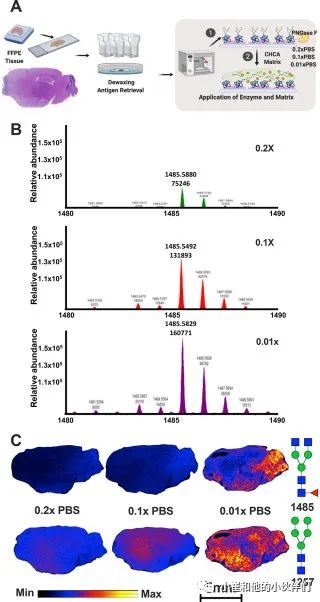
图1 MALDI-MSI工作流程,通过降低缓冲盐浓度提高分辨率
02小鼠阿尔茨海默病(AD)的额叶皮质高糖基化
为了进一步了解特定脑区N-连接聚糖的变化,作者团队应用改进的酶辅助MALDI-MSI工作流程对5xFAD和rTg4510(C57/B6 背景)与年龄匹配的C57/B6 WT对照小鼠的N-连接聚糖的变化进行了空间分析。在这项研究中,该团队重点研究小鼠大脑额叶皮层和海马内两个区域的N-连接聚糖变化,因为这两个区域的恶化与AD相关痴呆发作期间的行为缺陷和记忆力丧失密切相关。对于额叶皮层区域,聚类热图分析(图2A)和偏最小二乘判别分析(PLS-DA)均显示WT和5xFAD/rTg4510组之间存在明显的分离(图2B)。然而,这两种统计方法都无法区分5xFAD和rTg4510数据集,这表明两种动物模型中的痴呆症具有共同的N-连接聚糖表型(图2A-B)。VIP分析突出显示了在5xFAD 和rTg4510小鼠之间变化最大的N-连接聚糖种类,并按VIP评分进行排序(图2C)。此外,5xFAD/WT和rTg4510/WT的火山图均表明N-连接聚糖丰度的最显著变化被上调(图2D)。VIP分析突出的多个N-连接聚糖相对丰度的靶向分析显示,5xFAD和rTg4510小鼠的额叶皮层区域显著增加(图3A-D)。糖链1688、1743、1850 和 1339(均约至最接近的1 m/z)在两种 AD 小鼠模型中均显著上调,并且每种多糖的空间定量在不同的小鼠之间非常一致(图3A-D)。因此,他们的数据表明,5xFAD和rTg4510小鼠模型中N-连接聚糖表达的根本转变。
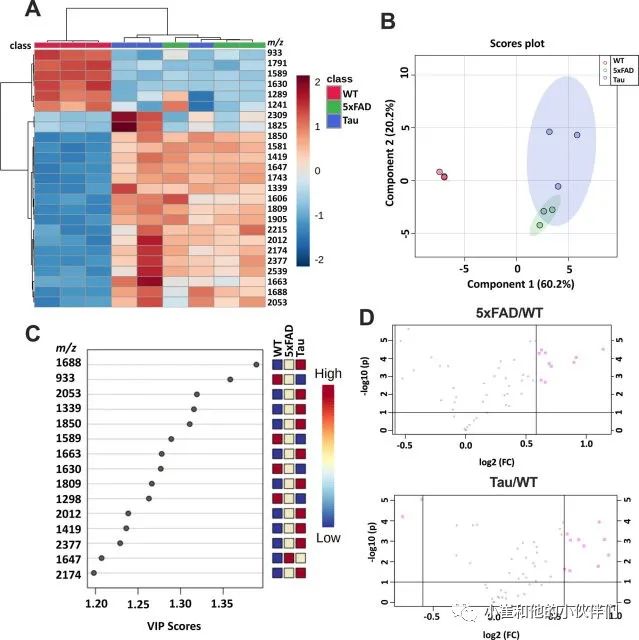 图2 小鼠阿尔茨海默病(AD)的额叶皮质高糖基化
图2 小鼠阿尔茨海默病(AD)的额叶皮质高糖基化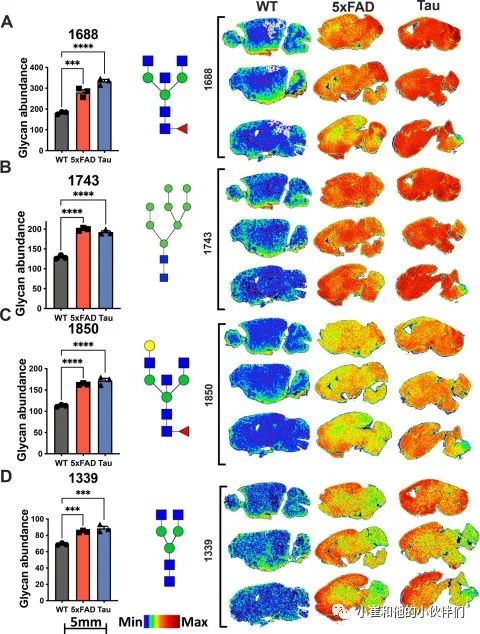 图3 小鼠阿尔茨海默病 (AD) 额叶皮质多个区域的N-连接聚糖增加
图3 小鼠阿尔茨海默病 (AD) 额叶皮质多个区域的N-连接聚糖增加
03高糖基化是人类阿尔茨海默病 (AD) 额叶皮质样本的显著表型
在两个AD小鼠模型中观察到的显著超糖基化引发了一个有趣的问题,即人类样本是否会表现相同的表型。作者从肯塔基大学阿尔茨海默病研究中心获得了三个人类额叶皮质(额叶中回,Brodmann第9区)和海马组织样本(Aβ斑块,Thal Aβ分期>3和tau病理,Braak NFT VI期),并与正常对照样本进行了匹配。与动物研究类似,该团队从每个额叶皮质切片中提取三个感兴趣区域,并对这些技术重复进行平均以获得每个样本的单一质谱。然后他们进行了多变量分析,以确定正常和AD 诊断之间的主要变化。尽管与小鼠分析相比,人类N-连接聚糖分析显示出更高的方差,但聚类热图分析(图4A-4B)和PLS-DA均显示正常组和AD组之间存在分离。在认知正常的对照组中,变化最大的N-连接聚糖物种产生了最显著的变化,AD样本通过VIP分析突出显示,并根据VIP评分和火山图进行排序(图4C-4D)。与小鼠AD额叶皮层数据类似,人类AD样本中所有显著改变的N-连接聚糖在灰质中均增加(图4D-4E)。通过对聚糖1809(约至最接近的1 m/z)的VIP分析突出显示N-连接聚糖相对丰度的靶向空间分析强调了额叶皮层的显著增加,这些变化是主要定位于人脑部分的灰质轨迹(图4E)。
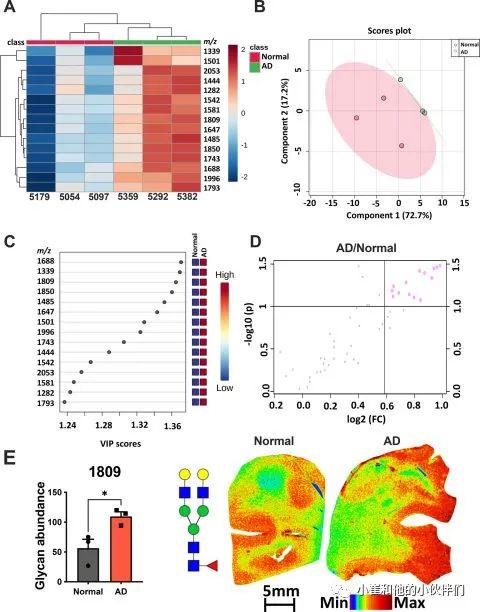
图4 人类阿尔茨海默病 (AD) 额叶皮质组织样本在灰质中高糖基化
04人类AD海马显示出相反的N-连接聚糖变化
海马体(尤其是)和额叶皮层是大脑中经常受到严重AD病理影响的区域;作者将分析扩展到三个具有AD诊断的人类海马组织样本。该团队从每个海马切片中提取了三个感兴趣的区域,并对这些技术重复进行平均以获得每个组织切片的单个质谱,然后他们进行了多变量分析,以确定正常和 AD 诊断之间的主要变化。聚类热图分析和PLS-DA均显示正常组和 AD 组之间存在分离(图5A-5B)。VIP分析突出显示了年龄匹配对照和AD样本之间变化最大的N-连接聚糖,并按VIP分数和火山图进行了排序(图5C-5D)。值得注意的是,人类AD海马区中所有改变的N-连接聚糖均减少了(图5C-5D)。通过VIP分析突出的N-连接聚糖(2174;约至最接近的1 m/z)相对丰度的针对性空间分析显示在海马区整个内嗅皮层 CA1 、CA2、CA3 或 Ammon 角均显著降低(图5E)。与小鼠模型相比,人类N-连接聚糖表现出更高的可变性。他们进一步比较了非AD人类和小鼠之间的全脑N-连接聚糖光谱分析,发现两个物种之间识别的N-连接聚糖数量没有差异(图6A)。这意味着N-连接糖基化途径在小鼠和人类的大脑中进化保守;因此,N-连接聚糖的失调表明AD进展过程中相反的代谢,特别是在海马中(图6B)。这些数据进一步支持研究小鼠和人类差异的生物学起源的需要,以及这些差异是否有助于AD小鼠模型和人类患者之间对治疗的不同反应。
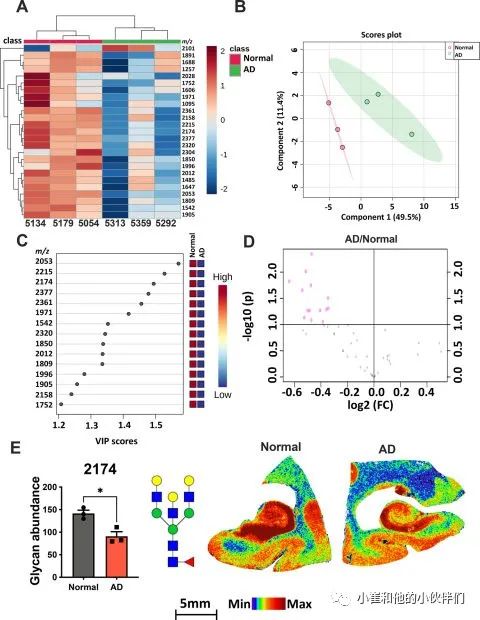
图5 人类阿尔茨海默病 (AD) 海马组织显示异质性低糖基化
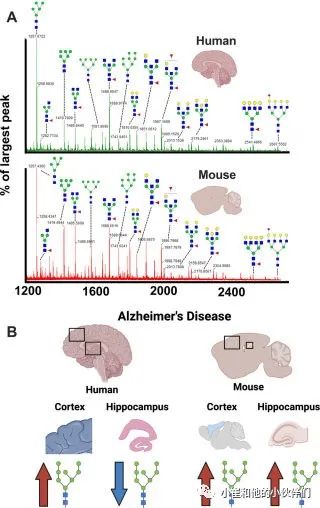
图6 阿尔茨海默病(AD)小鼠模型和AD人类大脑区域不具有相同的糖基化趋势
05
小 结
作者团队提出了一个用于产生新假设和开展更多研究的框架。例如进一步了解 (a) AD期间独特脑细胞群体中心碳代谢和N-连接聚糖生物合成之间的代谢通量;(b) N-连接糖基化干扰蛋白的识别;(c)高糖基化事件对神经元功能和改善临床环境中AD症状的潜在可逆性。未来的研究应包括定义中枢神经系统内导致异常N-连接聚糖表型的细胞类型,AD大脑独特细胞群和区域中通过不同代谢途径的葡萄糖利用的详细图谱,并确定N-连接聚糖代谢异常影响的信号通路。此外,使用生物流体和死后组织来确定轻度至重度认知障碍个体中N-连接聚糖的时间变化也将是有趣的。总的来说,AD中异质性异常N-连接糖基化的发现为发现痴呆-阿尔茨海默病症的新干预措施提供了有希望的途径。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






