CIRCULATION:主动脉瘤和解剖中平滑肌细胞表型改变的表观遗传诱导
2023-08-11 Jenny Ou MedSci原创 发表于上海
本研究揭示了AAD中SMC表型改变的动态表观遗传诱导,DNA损伤和细胞质渗漏驱动SMCs从收缩表型到炎症表型。
主动脉平滑肌细胞(SMCs)是一种具有显著表型可塑性的动态细胞群。在压力下,SMCs失去了它们的收缩表型,而获得了类似于成纤维细胞、炎症细胞、和其他表型的成骨细胞。越来越多的证据表明,SMC表型改变是胸腹主动脉瘤和夹层(AADs)的共同特征。然而,AADs中多样的SMC表型改变仍有待表征,驱动这些变化的机制仍有待确定。

单细胞RNA测序(scRNA-seq)和转座酶可及染色质单细胞测序(scATAC-seq)技术的最新发展为探索细胞表型变化的转录组学和表观基因组动力学提供了前所未有的机会。通过单细胞多组学分析和谱系追踪技术,我们在散发性AAD组织中检测到不同的SMC群体。
在AAD的发展过程中,SMCs从收缩型SMCs转变为增生性SMCs、炎症性SMCs、产生细胞外基质(ECM)的SMCs和死亡的SMCs,部分是通过表观遗传调控和染色质重塑。IRF3(干扰素调节因子3)被认为是SMC向促炎表型转变的关键驱动因素。
此外,通过刺激干扰素基因(STING)- irf3 - ezh2 (zeste homolog 2的增强子)信号传导,细胞内DNA积累诱导抑制H3K27me3修饰,抑制收缩基因的表达,同时诱导炎症基因的表达。最后,小鼠的Sting缺乏阻止了主动脉SMC的表型改变,这表明Sting - IRF3-EZH2通路是促进SMC向促炎方向转变的关键信号通路。
2023年8月9日发表在CIRCULATION,研究人员通过单细胞RNA测序和转座酶可及染色质单细胞测序检测血管紧张素ii诱导的AAD小鼠主动脉SMC表型变化的转录组学和表观基因组动力学。应用单细胞RNA测序分析,研究了升胸AAD患者主动脉SMC表型改变。
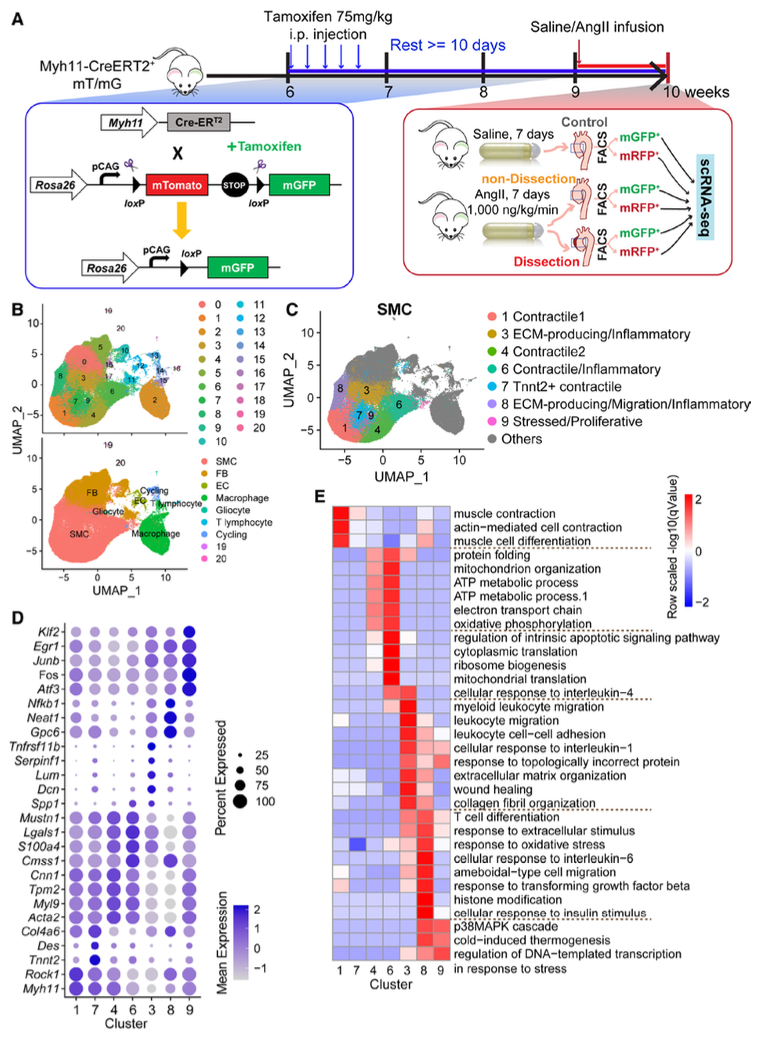
单细胞分析揭示了SMC谱系示迹小鼠主动脉壁细胞群的异质性
单细胞RNA测序分析显示,主动脉应激诱导SMCs从主要的收缩表型向增殖、细胞外基质生成和炎症表型转变。谱系追踪显示SMCs完全转化为成纤维细胞和巨噬细胞。转座酶可及染色质分析的单细胞测序分析表明,这些表型改变是由染色质重塑控制的,其特征是收缩基因的染色质可及性降低,以及与增殖、细胞外基质和炎症有关的基因的诱导染色质可及性。
IRF3(干扰素调节因子3)是一种由细胞质DNA激活的促炎转录因子,被认为是主动脉SMCs从收缩表型向炎症表型转变的关键驱动因素。在培养的SMCs中,胞质DNA通过其传感器STING-TBK1 (tank-binding kinase 1)发出信号激活IRF3, IRF3结合并募集EZH2 (zeste homolog 2的增强子)到收缩基因,诱导抑制H3K27me3修饰和收缩基因抑制。
相反,双链DNA-STING-IRF3信号通路诱导SMCs中的炎症基因表达。在Sting - / -小鼠中,主动脉应激诱导的SMC向炎症表型的转变被阻止,SMC种群得以保存。最后,在人类升胸AAD组织中检测到SMC向不同方向的深刻表型改变。
在这项研究中,对散发性AAD小鼠模型和人类胸部AAD组织的scRNA-seq分析显示,从收缩型SMCs到其他几种表型(包括促炎表型)的显著表型转换。ScATAC-seq分析进一步表明,SMC转化部分受染色质重塑控制。
此外,IRF3被确定为驱动这些变化的顶级TF。在培养的人主动脉SMCs中,IRF3直接与SMC收缩基因的顺式元件结合,募集EZH2,诱导收缩基因的抑制性H3K27me3修饰,导致收缩基因抑制。最后,在我们的散发性AAD小鼠模型中,Sting缺乏阻止了SMC表型向促炎表型的转变,并维持了收缩表型。
原文出处
Chakraborty, A.; Li, Y.; Zhang, C.; Li, Y.; Rebello, K. R.; Li, S.; Xu, S.; Vasquez, H. G.; Zhang, L.; Luo, W.; Wang, G.; Chen, K.; Coselli, J. S.; LeMaire, S. A.; Shen, Y. H., Epigenetic Induction of Smooth Muscle Cell Phenotypic Alterations in Aortic Aneurysms and Dissections. Circulation 0 (0).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言