药品有效期是否就等于使用期?
2019-01-26 辛莉、钟婉芳 逸仙药学V
药品有效期是指药品在规定的贮存条件下保证药物质量的期限。是根据药品的稳定性不同,通过稳定性实验研究和留样观察而制订的。
药品有效期是指药品在规定的贮存条件下保证药物质量的期限。是根据药品的稳定性不同,通过稳定性实验研究和留样观察而制订的。
但在药品的使用过程中,由于改变了原外包装,其贮存条件发生改变,药品的稳定性也可能有所改变,原有效期不再适用。

一、先从读懂药品的有效期开始
根据现行的2006年版《药品说明书与标签管理规定》中第3章第23条规定:药品标签中的有效期应当按照年、月、日的顺序标注,年份用四位数字表示,月、日用两位数表示。其具体标注格式为「有效期至××××年××月」或者「有效期至××××年××月××日」。
例如:「有效期至2020.04」,是指该药品可用到2020年04月30日。如若注明到日,则表示该药品只能使用到该日。
也有标注有效期为X年或XX个月,则可根据药品的生产日期来推断,如药品的生产日期为2018年11月15日,有效期为24个月,则表示药品可使用到2020年11月14日。
在1992年版《药品生产质量管理规范》中提到批号的定义为:用于识别「批」的一组数字或字母加数字;用之可以追溯和审查该批药品的生产历史。
虽然该规范已被修订,在现行的2010年版《药品生产质量管理规范》中没有明确要求药品的生产批号要追溯到生产日期,只作为识别一个特定批的具有唯一性的数字和(或)字母的组合。
但仍有些药品生产批号依旧可以追溯到药品生产时间,根据药品的有效期即可推算出具体有效期。如批号为1803082,有效期为24个月,则有效期为2020年03月07日。
进口药品常以「Expiry date」「Expiration Date(EXP)」(截止日期)表示失效期,或以「Use before」(在…之前使用)表示有效期。
不同国家的日期表达方式不一样,应注意分辨。
二、了解具有明确使用期限的制剂
为区分药品原标注的有效期,将药品原包装开启后的有效期定义为药品的使用期限。
目前,中国药典2015年版第四部已有明确规定:除另有规定外,多剂量的眼用制剂(眼膏、滴眼液等)、鼻用制剂、涂剂、涂膜剂等在开启后使用期最多不超过 4 周。值得留意的是一些眼用制剂的使用期限较短,应特别留意说明书上标注的使用期限,如氨碘肽滴眼液,开启使用期限仅为10天。冲洗剂开启后应立即使用,未用完的应弃去。
如果药品说明书有具体规定,则依照药品说明书规定,如使用中的胰岛素可在室温保存28天。
也有相关报道指出:通常糖浆剂开启后在室内常温(25℃ 以下)下可保存 1~3 个月。 一般冬天不超过 3 个月,夏天不超过 1 个月。口服溶液剂、混悬剂和乳剂在瓶口及瓶盖未受污染的情况下,可在室温下保存两个月。
三、重新包装的药品,使用期限重新定义
在医院药房中,某些专科药物、贵重药物经常被拆分为单剂量包装。
目前我国药典尚未有对重新包装后的药品有效期进行相关规定。但有相关报道提出:任何药品在开封后应尽快用完,不可再参照包装上面的有效期存放和服用。
对于未开启的或有单剂量独立内包装药品,应按药品说明书规定的贮存条件保存,开封前的保存期可至药品标示的有效期。
对于胶囊、滴丸等药品容易吸潮,开封后应尽快服用完毕,一般应在3个月至半年内用完。
服用药水应在疗程期间服用完毕。
药品开启后进行冷藏保存,其意义在于保证短期使用质量,而不是长期储存。
美国药典指出:药品经过分包装后,药品的稳定性不同于原包装的药品,故不能使用原包装药品的有效期,并用”beyond-use date”即在此日期之前使用(BUD)与药品的有效期(expiration date)进行区分。
除另有规定外,药品重新包装后的使用期限不得超过分装日期起之后1年或者生产企业包装上标注的有效期,以较早者为准。
另外,在FDA发布的执法政策指南《重新包装于单剂量容器中固体制剂的有效期》中说明:重新包装后的固体制剂有效期自重新包装之日起不应超过6个月或药品剩余有效期的25%,以较早者为准。
四、药物的配制制剂(例如某些医院制剂)使用期限有参考
药物配制是指当市售药物不能满足需要时(如患者对市售药品不能耐受、市售药品无法满足严密的制备要求或者患者需要的药物面临短缺或停产),药师根据患者个体化需求对药物制剂进行制备和调剂。
对于药品的配制制剂一般情况下要求为现配现用,仅作为短期储存。在美国药典以及国家处方集里有收录部分的配制制剂,里面对各制剂的BUD进行了考察并给出了相关的使用期限。对于其他没有被收录的配制制剂则根据专业经验分配。对于非无菌制剂,在USP通则中给出了推荐的最大BUD,如下表。
表1 USP 通则中不同配方类型的 BUD

五、使用期限与贮存条件密不可分
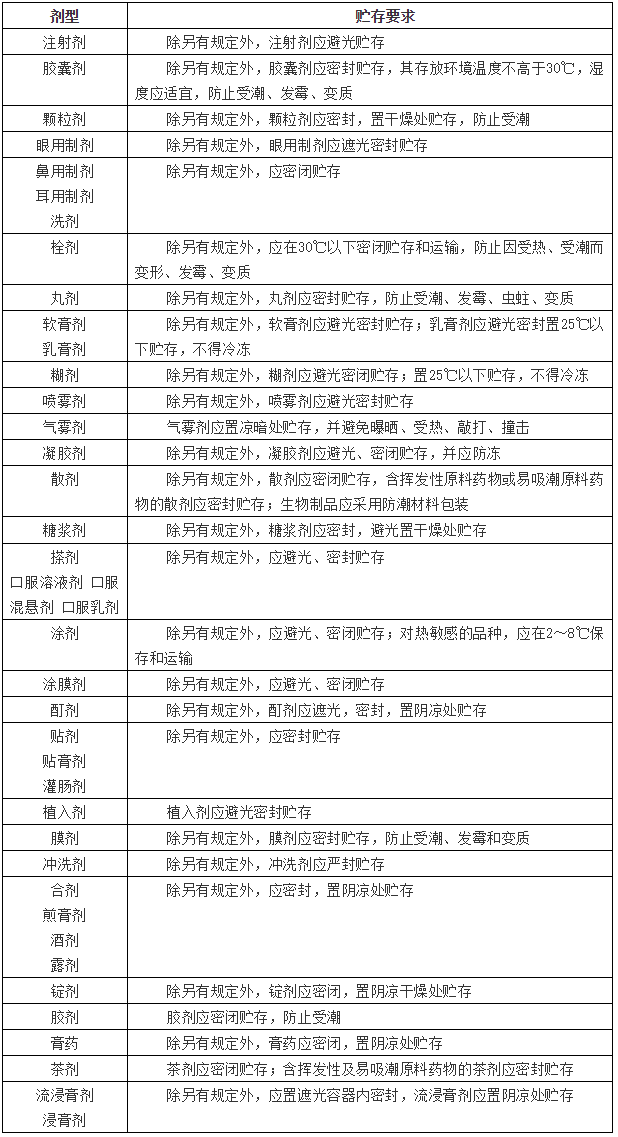
药品在开启之后,由于贮存条件发生变化而导致原有效期不再适用,只作为一个参考值。在药品使用过程中应注重药品的贮存方式,以避免药品发生变质,提高药品的用药安全性。下表列出我国药典2015年版第四部通则中对各剂型药品储存的相关要求。
表2 ChP(2015年版)通则中对各剂型药品储存的相关要求
六、小贴士
在有效期内使用药品是保证用药安全的基本前提。在给药前应特别留意药品的性状是否发生变化,仔细辨别药品是否受潮软化、变质(发霉、异味、结块、粘连、产生气体、絮状物、沉淀物、变色)等,如有发现药品性状发生改变,即使在有效期内也不能使用。
在日常药品管理中,瓶装药品开封后应丢弃里面的棉花和干燥剂,避免二者吸附水汽成为药瓶内部污染源,从而使瓶内药物潮湿变质;对于拆零药品还应及时标注药品的有效期及开封日期等;注重定期检查药品情况,近效期药品加以标注,同时也要注重药品的储存条件,恰当的储存方式是保证药品质量安全的前提。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











