IVD技术丨肺炎支原体和衣原体核酸检测(CRISPR/Cas系统)
2023-12-05 小桔灯网 小桔灯网 发表于上海
本文将从CRISPR/Cas9基因编辑技术的原理、优势、应用领域和存在的挑战等方面,分析其在分子诊断产品上的应用前景。
导读:近年来,随着基因编辑技术的发展,CRISPR/Cas9系统作为一种高效、精确和灵活的基因编辑工具,引起了广泛的关注和研究。CRISPR/Cas9基因编辑技术是否能够用于分子诊断产品的开发,是一个值得探讨的问题。本文将从CRISPR/Cas9基因编辑技术的原理、优势、应用领域和存在的挑战等方面,分析其在分子诊断产品上的应用前景。
01 CRISPR简介
CRISPR技术是一种利用细菌的自然免免疫系统来编辑生物体的基因的方法。技术应用包括疾病诊断、基因治疗、农业育种等。技术原理是利用一种叫做Cas9的核酸酶,它可以在目标DNA上切割,从而引发基因的突变或删除。为了让Cas9能够精确地识别和切割目标DNA,它需要与一种叫做gRNA的小分子RNA配合使用。gRNA可以与目标DNA上的特定序列结合,形成一个特异性结合位点(spacers),这样Cas9就可以通过这个结合位点找到并切割目标DNA。据Mordorintelligence分析CRISPR技术市场规模预计将从2023年的31.5亿美元增长到2028年的77.9亿美元,在预测期间(2023-2028年)的复合年增长率为19.89%。
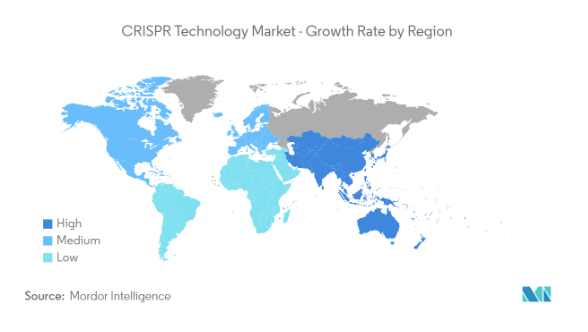
图源自:Mordorintelligence报告
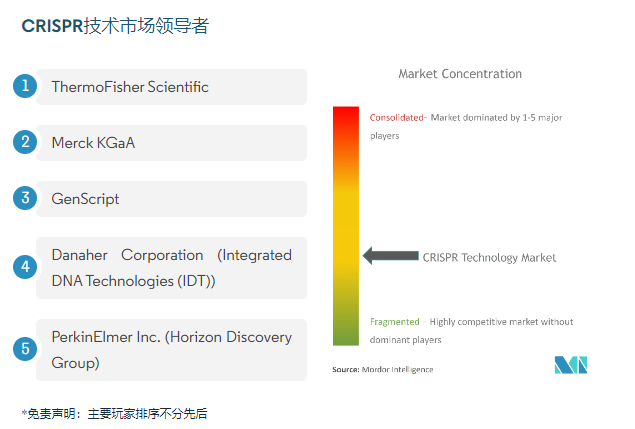
图源自:Mordorintelligence报告
02 市场产品总结
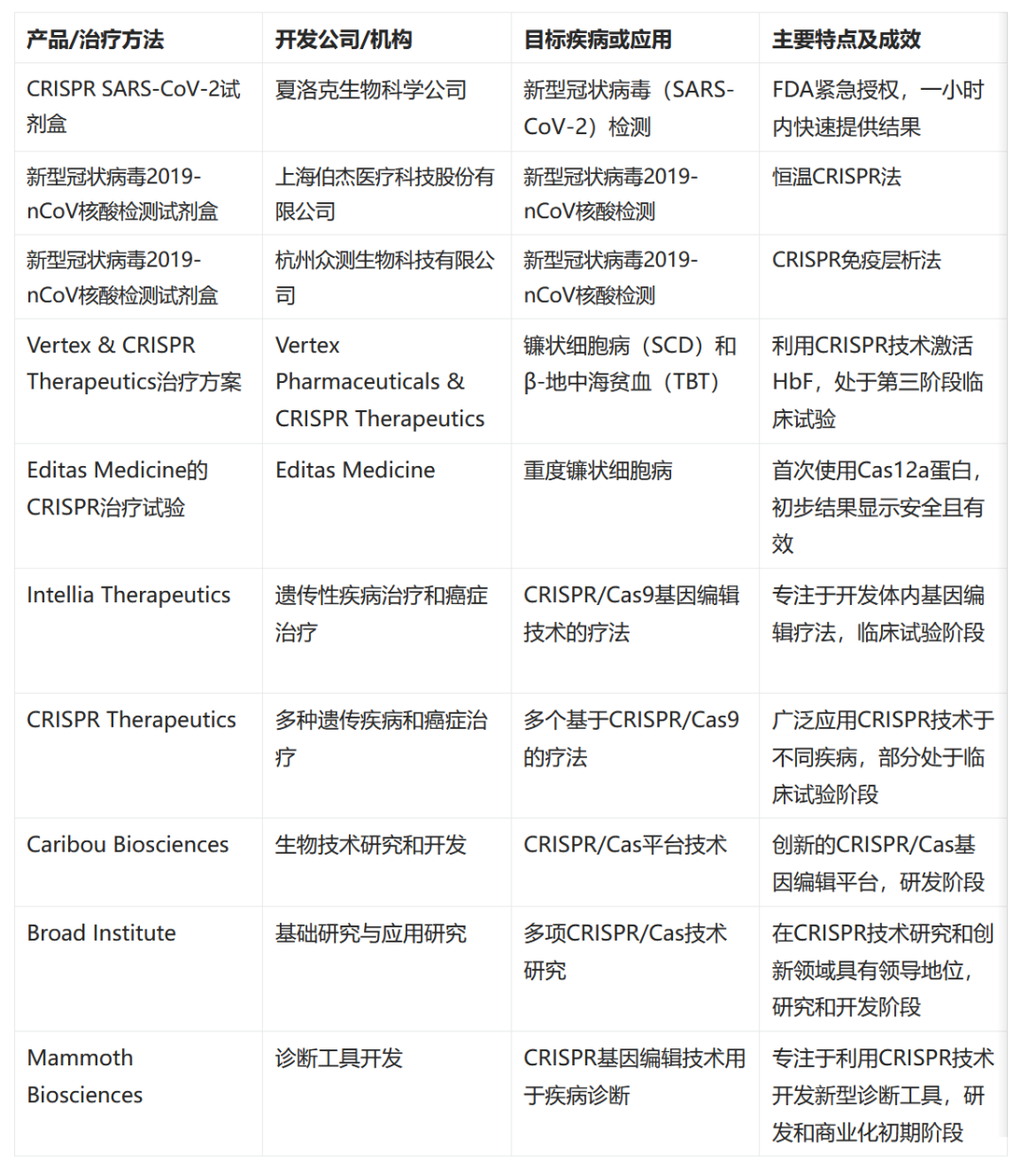
03 产品开发实例
肺炎支原体和衣原体感染通常表现为肺炎等呼吸道疾病,及时准确的诊断对于有效治疗和控制传播至关重要。CRISPR/Cas系统通过特定的引导RNA(gRNA)精确识别目标DNA序列。在分子诊断中,这一特性可用于识别和分析特定病原体的DNA。CRISPR/Cas系统可以被定制来识别肺炎支原体和衣原体的特定DNA序列,提供准确的诊断信息。与传统的培养和PCR方法相比,CRISPR/Cas系统能够在较短时间内完成检测,加快诊断流程。CRISPR/Cas系统在低丰度样本中的高灵敏度使其成为检测早期感染的理想工具。
1. 设计和制备特异性引导RNA(gRNA)
确定肺炎支原体和衣原体特有基因保守区域作为靶标区域,选择这些病原体的特定基因,如肺炎支原体的P1蛋白基因或衣原体的ompA基因在不同菌株中高度保守的DNA序列。利用在线CRISPR设计工具(如CRISPOR、Benchling)输入靶标区域的序列。这些工具会提供一系列潜在的gRNA靶标位点,通常这些位点位于Cas9蛋白识别的PAM序列(例如NGG)附近。选择与目标DNA高度互补的20个核苷酸序列作为gRNA序列。考虑gRNA的结合效率和特异性,避免与人类基因组或其他微生物基因组的非特异性结合。通过比对数据库进行非特异性结合风险评估,确认所选gRNA序列不会与非目标序列产生高度相似性。将设计好的gRNA序列提交给合成服务或使用体外转录方法进行gRNA合成。在实验室条件下验证所设计的gRNA对目标DNA的识别和切割效率。注意为了确保高效率和特异性,设计多个候选gRNA进行测试,确保gRNA不会与人类基因组或其他常见微生物的基因组产生交叉反应。
2. 准备CRISPR/Cas复合物
准备CRISPR/Cas复合物是实施CRISPR/Cas基因编辑技术的一个关键步骤。
一般过程为:根据应用需求选择适合的Cas蛋白,如Cas9、Cas12或Cas13。例如,Cas9通常用于DNA靶向,而Cas13用于RNA靶向。购买已经纯化和验证过的Cas蛋白,如果有条件可以通过细菌表达系统在实验室中表达并纯化Cas蛋白。如前所述,设计特定的gRNA,针对目标DNA或RNA序列。gRNA可以通过合成或体外转录的方式制备。将纯化的Cas蛋白与合成的gRNA混合,通常在体外进行。混合比例和条件需根据具体的Cas蛋白和gRNA调整。将Cas蛋白和gRNA混合物在适当的缓冲液中孵育,以允许gRNA与Cas蛋白结合。孵育时间和温度根据具体的Cas蛋白和gRNA类型而有所不同。使用已知的靶标DNA或RNA验证CRISPR/Cas复合物的切割或结合活性,以确保复合物的功能性。根据需要将CRISPR/Cas复合物保存在适当的条件下,通常是低温保存。定期检测其活性,确保在使用时保持有效性。
注意:第一,不同的Cas蛋白和gRNA可能需要不同的比例和反应条件。第二,确保Cas蛋白和gRNA的高纯度和质量,这对实验的成功至关重要。第三,在操作过程中需要严格遵循实验室的标准操作流程,避免污染和降解。准备CRISPR/Cas复合物是一个精细的过程,需要根据具体的Cas蛋白和gRNA调整条件。在实验室条件下,通过严格的操作和验证,可以确保CRISPR/Cas复合物的有效性和稳定性,为后续的基因编辑或分子诊断实验打下坚实基础。
3. 样本处理
从疑似感染肺炎支原体或衣原体的患者中收集呼吸道标本,如咽拭子、痰液或支气管灌洗液。从收集的样本中提取总DNA或RNA。
4. CRISPR/Cas介导的检测
将提取的核酸与CRISPR/Cas复合物混合,允许gRNA引导Cas蛋白到特定序列进行结合。在适宜条件下进行反应,通过Cas蛋白的切割活性来识别目标DNA。根据不同的Cas蛋白,检测方法可能包括PCR扩增、荧光信号检测或其他生物化学方法。
根据目标序列选择合适的Cas蛋白(例如Cas9、Cas12、Cas13等)和相应的引导RNA(gRNA),并将它们混合以形成CRISPR/Cas复合物。从相关样本(例如细胞、组织、体液等)中提取总DNA或RNA,如果目标序列含量低,可能需要先进行扩增(如PCR扩增)。将CRISPR/Cas复合物与提取的DNA或RNA混合,根据需要设定合适的反应条件,如温度和时间。对于Cas9:观察是否发生了DNA的特异性切割;对于Cas12或Cas13:这些蛋白在识别目标序列后会展现“非特异性切割活性”,可通过报告分子(如荧光标记的DNA或RNA)来检测信号的变化。根据检测系统的设计,可能需要使用荧光显微镜、荧光检测器或凝胶电泳等方法来观察和分析反应结果。评估信号的出现或变化,如荧光强度的增加或减少,来判断是否检测到目标序列。根据信号强度或模式,分析和解释实验结果。对于定量分析,可能需要比较不同样本或处理条件下的信号差异。使用已知阳性和阴性对照进行实验验证。为确保结果的准确性和重复性,进行多次实验。
注意:确保CRISPR/Cas系统的设计具有高特异性和灵敏度,以减少假阳性或假阴性结果。可能需要根据具体的Cas蛋白和gRNA,以及目标序列的特性来优化实验条件。正确解释实验数据,特别是在处理复杂的生物样本时。CRISPR/Cas介导的检测是一种强大而灵活的方法,可以用于精确地检测和分析特定的DNA或RNA序列。通过仔细的实验设计和严格的操作流程,这种方法可以提供高度特异性和灵敏度的检测结果。
5. 结果分析
根据CRISPR/Cas系统设计的检测方式,通过特定的信号变化(如荧光强度变化、电泳条带模式等)来判断样本中是否含有目标DNA。根据检测到的信号强度或模式,判断样本是否含有肺炎支原体或衣原体的DNA。
通过荧光强度变化判断样本中是否含有目标DNA是一种常见的分子诊断方法,尤其在CRISPR/Cas系统的应用中非常有效。这个过程涉及到利用特定的荧光标记物,其发光信号的变化与目标DNA的存在直接相关。
具体的步骤和原理:首先引入荧光标记物,在CRISPR/Cas系统中,使用荧光标记的报告分子(例如荧光染料或荧光标记的核酸探针)。这些荧光标记物通常设计为在未切割状态下抑制发光。然后CRISPR/Cas介导的检测,将含有荧光标记物的CRISPR/Cas系统与样本混合。如果样本中含有目标DNA,CRISPR/Cas复合物会识别并结合到这些序列。对于如Cas12或Cas13的CRISPR系统,一旦识别到目标DNA,它们会激活非特异性切割活性,从而切割包括荧光标记的报告分子在内的其他核酸。再者观察荧光信号变化,在CRISPR/Cas系统未结合到目标DNA时,荧光标记物被抑制,不发出明显的荧光信号。当CRISPR/Cas系统识别并结合到目标DNA时,激活的Cas蛋白会切割荧光标记物,释放荧光信号。使用荧光检测设备(如荧光定量PCR仪、荧光显微镜或荧光读板机)检测信号的强度。其次数据分析,比较实验样本和对照样本(已知不含目标DNA)的荧光强度。荧光强度的显著增加表明样本中可能含有目标DNA。最后验证和重复实验,使用已知含有目标DNA的阳性对照和已知不含目标DNA的阴性对照进行验证实验。重复实验以确保结果的一致性和可靠性。
注意,第一选择适合实验系统的荧光标记物非常重要,需要考虑到其灵敏度和特异性。第二,实验过程中应避免样本污染和非特异性荧光信号。第三,确保荧光信号的检测和量化精确无误,这通常需要合适的标准曲线和定量分析方法。
6. 确认和验证
为了确保结果的准确性,对阳性样本进行重复检测。使用已知阳性和阴性样本作为对照,确保实验的准确性和可靠性。
开发针对肺炎支原体和衣原体特异性的引导RNA(gRNA)是关键。确保系统不与非目标DNA发生交叉反应,以提高诊断的准确性。为了使CRISPR/Cas系统在实际临床环境中易于应用,需要简化测试流程和设备要求。开发成本效益高的检测方案,使其对于广泛的临床应用更具吸引力。
随着CRISPR/Cas技术的不断发展和优化,预计未来将开发出更多针对肺炎支原体和衣原体DNA的高效检测产品。这些产品将对呼吸道感染的诊断和治疗产生重要影响,有助于提高公共卫生管理的效率。CRISPR/Cas系统在检测肺炎支原体和衣原体DNA方面具有巨大的应用潜力。随着技术的进一步发展,该系统有望成为呼吸道病原体检测的重要工具,提高诊断的准确性和效率。以此不妨再进一步,探索其他的应用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Crispr技术# #基因编辑技术#
36